Ikdienā Kārlis Pleiko nodarbojas ar nieru karcinomai specifisku aptamēru mērķa proteīnu identificēšanu. Darbs pie promocijas darba norit LU Medicīnas fakultātes Farmakoloģijas katedrā profesores Unas Riekstiņas vadībā. Pateicoties mecenāta “Mikrotīkls” atbalstam, sadarbībā ar LU fondu Kārlis īstenoja projektu, lai izstrādātu agrīnās diagnostikas metodi ļaundabīgu nieru audzēju noteikšanai – aptamēru biosensora izstrāde minimāli invazīvai gaišo šūnu nieru karcinomas diagnostikai. Nākamais solis ir promocijas darba izstrāde, ko visus doktorantūras studiju gadus sekmē iegūtā “Mikrotīkls” doktorantūras stipendija eksakto, dzīvības un medicīnas zinātņu jomā.
Kā un kad aizsākās aizsākās tavi nieru karcinomas pētījumi Latvijas Universitātē?
Profesores U. Riekstiņas vadītā preklīniskās izpētes laboratorija, kurā strādāju ar audzējam specifisku aptamēru atlasi, darbojas salīdzinoši nesen. Pirmo reizi laboratorijā mēģinājām strādāt ar aptamēriem mana bakalaura darba izstrādes laikā 2015. gadā. Šobrīd esam publicējuši zinātnisko rakstu par nieru karcinomas specifiskiem aptamēriem starptautiski recenzētā žurnālā Scientific Reports.
1.  2.
2. 
3.  4.
4. 
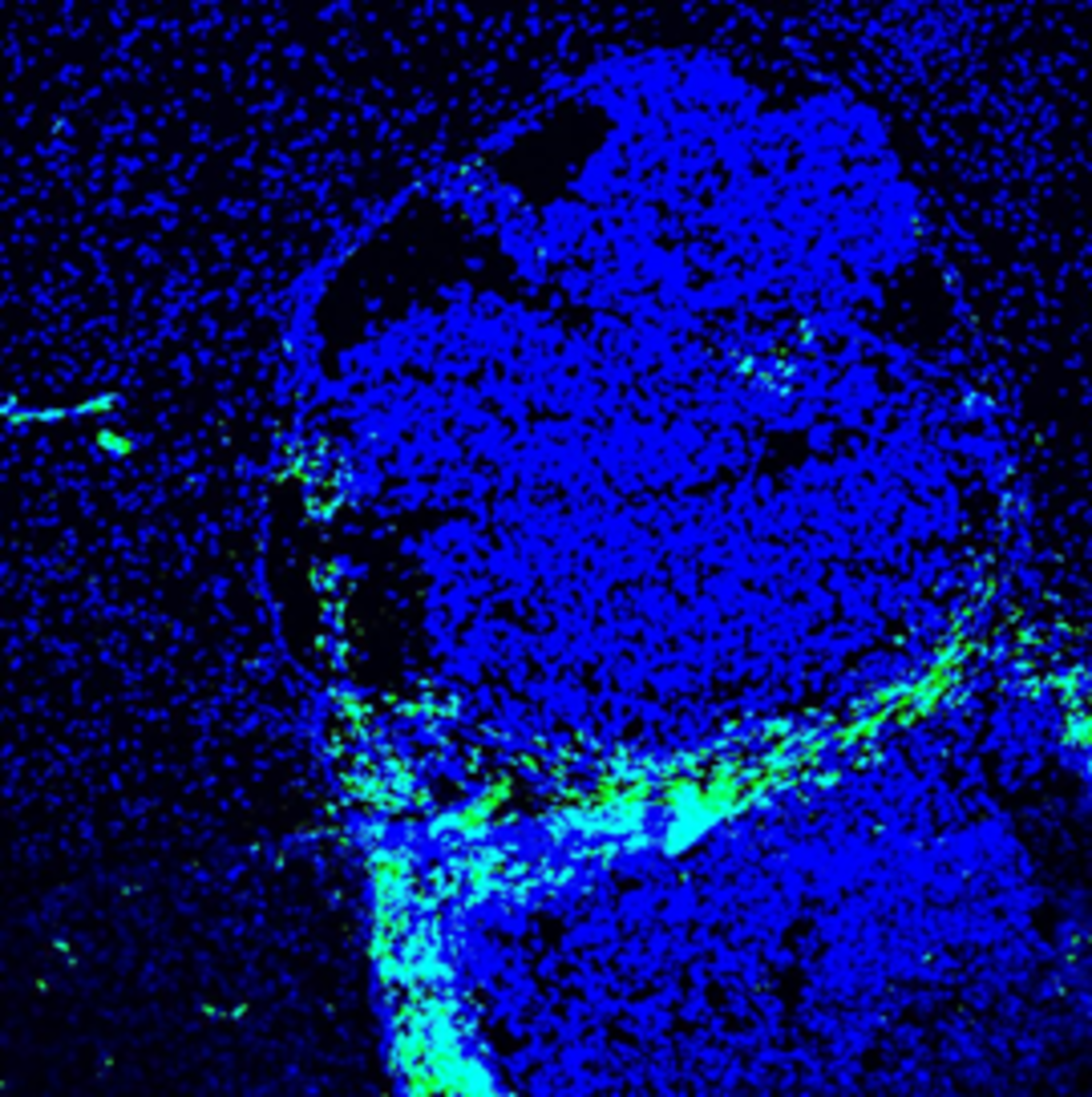
Iegūtie mikroskopijas attēli, strādājot Tartu Universitātē. Atlasīti 10 aminoskābju gara peptīda līdersekvence, kas selektīvi nonāk līdz audzēja "in vivo" audzēja peļu modelī. Ar šo peptīdu plānots veikt turpmākus pētījumus, lai noskaidrotu precīzu molekulāro mērķi. 1. Zils – DAPI (šūnu kodoli, blīvāks krāsojums iezīmē audzēja robežas); Zaļš – CD206 (audzēju atbalstošu makrofāgu marķieris). 2. CD-206. Sarkans – līderpeptīds. 3. Sarkans – līderpeptīds. 4. Zils – DAPI. Sarkans – līderpeptīds. Autors – Kārlis Pleiko.
Kāda ir tava pētījuma aktualitāte? Kā tas palīdzēs zinātnei un sabiedrībai?
Izskaitļots, ka nieru audzēji sastāda 2-3% no visiem audzējiem pieaugušo populācijā. Tieši gaišo šūnu nieru karcinoma ir visizplatītākais apakštips. Aptamēri ir īsi oligonukleotīdi, kas ar savu molekulāro mērķa proteīnu saistās, pateicoties to 3D struktūrai. Aptamēri tiek galvenokārt izmantoti diagnostiskam un terapeitiskam pielietojumam. Izmantotā šūnu-SELEX metode ļauj atlasīt aptamērus, kas specifiski saistās pie kāda uz šūnas virsmas esoša proteīnu mērķa.
Iepriekšējos mūsu grupas pētījumos ar šūnu-SELEX metodes palīdzību ir atlasīti aptamēri, kas saistās pie audzēja šūnām, bet nav zināms proteīnu mērķis, pie kura tie saistās. Cikla noslēgtība pētījumā izpaužas kā mērķa proteīna identificēšana, izmantojot masas spektrometrijas analītiskās metodes. Joprojām lielākajā daļā šūnu-SELEX aptamēru mērķis netiek identificēts, ievērojami samazinot iespējamo aptamēra izstrādi terapijā vai diagnostikā. Proteīnu mērķi nepieciešams noskaidrot, ja plānots aptamēru tālāk attīstīt kā terapeitisku vai diagnostisku līdzekli. Ja mērķa proteīns nav zināms, tad nav iespējams arī noskaidrot, kā aptamēra saistīšanās pie audzēja šūnām ietekmē dažādus molekulāros signālceļus.
Zinātnisko novitāti raksturo pētījuma dizaina uzlabojumi, iekļaujot pacienta veselo audu un audzēja šūnu izmantošanu. Liela caurplūduma sekvencēšanas (angļu val.: high throughput sequencing) izmantošana ļaus ar daudz lielāku jutību apskatīt aptamēru atlases īpatnības.
Ar ko tu šobrīd nodarbojies pētnieciskā darbā?
Pašreiz ERASMUS+ studiju apmaiņas programmas ietvaros darbojos Vēža bioloģijas grupā Tartu Universitātē, Igaunijā. Grupas vadītājs prof. Tambet Teesalu iepriekš saņēmis prestižo Eiropas Pētniecības padomes grantu glioblastomas mērķētās terapijas līdzekļu attīstīšanai.
Profesors Teesalu pētījumus mērķētas terapijas jomā veic jau vairāk nekā 10 gadus, un viņa vadītajai laboratorijai ir izveidojusies spēcīga sadarbība ar inovatīviem zāļu izstrādes uzņēmumiem, lai pēc audzēja specifisku peptīdu identificēšanas būtu iespējams tos tālāk attīstīt kā terapeitiskos līdzekļus klīnikā.
Ar ko nodarbojas pētnieciskā grupa, kurai esi pievienojies?
Mana disertācijas tēma saistīta ar vēža mērķētās terapijas izstrādi, un profesora Teesalu izmantotā pieeja ir tehniski līdzīga. Mūsu pētniecības grupā tiek izmantoti aptamēri jeb īsas nukleīnskābes (DNS un RNS veidojošās vienības), kurām piemīt specifiska 3D struktūra, kas nodrošina to saistīšanos ar audzēja šūnām, neskarot veselās šūnas. Profesora Teesalu grupa galvenokārt izmanto īsus peptīdus (sastāv no aminoskābēm jeb proteīnus veidojošajām vienībām), kas atlasīti ar fāgu displeja metodi, lai panāktu specifiskumu pret audzēja šūnām.
Profesora Teesalu grupā darbojos ar jaunu glioblastomas mērķētu peptīdu atlasi, izmantojot LU Medicīnas fakultātes prof. Unas Riekstiņas laboratorijā izstrādāto sekvencēšanas datu analīzes algoritmu un atlasīto specifisko peptīdu testēšanu in vivo modeļos pelēs, kurām ierosināts glioblastomas audzēja modelis.
Kas ir lielākā priekšrocība, strādājot starptautiskā pētnieciskajā vidē?
Vislielākais ieguvums, atrodoties Tartu, ir tieši priekštats par to, kā nepieciešams organizēt darbu, lai pētniecība mērķētās terapijas lauciņā paliktu ne tikai laboratorijā, bet to būtu iespējams pēc tam arī attīstīt tālāk. Vēlos pateikties LU fondam un mecenātam “Mikrotīkls” par sniegto atbalstu! Piešķirtā stipendija sniedz milzīgu atbalstu, lai es varētu sekmīgi turpināt savu darbību zinātnē.
KĀRĻA FAKTU KASTE
Absolvētās fakultātes? LU Ķīmijas fakultāte un LU Medicīnas fakultāte. Mīļākā šūna? Pēdējā laikā darbojos ar glioblastomas cilmes šūnām, un ir stāvoklis, kurā audzēja cilmes šūnas var novest, kad tās vairs nespēj neierobežoti dalīties jeb absorbējošais stāvoklis. Šajā sakarā mīļākā šūna ir tāda, kuru ir izdevies novest šādā absorbējošā stāvoklī, no kura tā vairs nespēj tik prom un ierosināt audzēja atkārtotu parādīšanos. Iedvesmojošākais zinātnieks? Dženifera Doudna (Jennifer Doudna) un Emanuēla Šarpentjēra (Emmanuelle Charpentier) – vienas no CRISPR-Cas9 genoma rediģēšanas sistēmas atklājējām. Molekulārā biologa dzīves moto? Nekad neuzticies pirmajiem pozitīvajiem rezultātiem. Svarīgākās iniciatīvās zinātnē? Atvērtā zinātne (brīvpieejas zinātniskie raksti, kods, sākotnējie dati). |
Par Latvijas Universitātes fondu
Jau kopš 2004. gada Latvijas Universitātes fonds nodrošina iespēju mecenātiem un sadarbības partneriem atbalstīt gan LU, gan citas vadošās Latvijas augstskolas, tā investējot Latvijas nākotnē. LU fonda prioritātes ir atbalstīt izcilākos studentus un pētniekus, veicināt modernas mācību vides izveidi, kā arī universitātes ēku būvi un rekonstrukciju.

 Akadēmiskais centrs
Akadēmiskais centrs